Terdapat dua benda A dan B, benda A dirasa dingin oleh
tangan dan benda B dirasa panas oleh tangan. Apabila kedua benda tersebut
disentuhkan, pada keduanya akan terjadi sifat. Pada suatu saat tidak terasa
lagi perubahan sifat tersebut maka A dan B dikatakan mencapai kesetimbangan
termal. Sifat yang berubah ini disebut suhu.
Postulat: bila dua sistem satu sama lain
berada dalam kesetimbangan termal, suhu kedua sistem tersebut adalah sama.
Jika kita dapat mengatakan bahwa A dan B mempunyai suhu yang sama. Dari
postulat ini timbul hukum ke nol
termodinamika yang berbunyi: jika
dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, ketiga
sistem tersebut berada dalam kesetimbangan termal satu sama lain. Apabila
sistem A berada dalam kesetimbangan termal dengan C, sedangkan sistem B dalam
kesetimbangan termal dengan C, A berada dalam kesetimbangan termal dengan B.
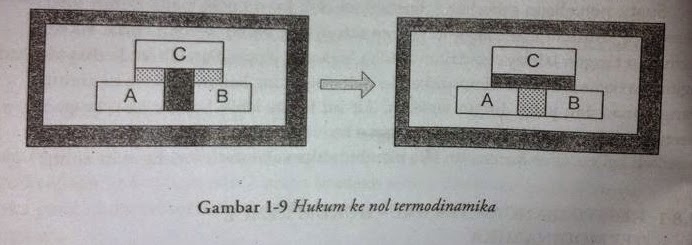
Dari hukum ini kita dapat simpulkan bahwa untuk mengetahui apakah dua sistem
mempunyai suhu yang sama, tidak perlu kedua sistem tersebut disentuhkan, gambar
1-9 (a) menunjukkan sistem A dan B dipisahkan dengan dinding adiabatik, tetapi
masing-masing bersentuhan dengan C melalui sebuah dinding diatermal, dinding diatermal adalah permukaan
batas yang menyebabkan adanya interaksi dengan lingkungan tersebut. Dinding
diatermal yang sering dijumpai adalah lempengan logam yang tipis. Seluruh
sistem dikurung oleh dinding adiabatik. Sistem A dan B akan berada dalam
kesetimbangan termal dengan C. kemudian A dan B dipisahkan dengan dinding
adiabatik terhadap C, sedang sistem A dan B dihubungkan dengan dinding
diatermal, maka sistem A dan B akan berada dalam kesetimbangan termal,
ditunjukkan pada gambar 1-9 (b).
Jadi suhu adalah sifat sistem yang menentukan apakah
sistem itu setimbang termal dengan sistem lainnya atau tidak. Apabila dua
sistem atau lebih berada dalam kesetimbangna termal, keduanya diakatakan mempunyai
suhu yang sama.
Hukum
ke 0 termodinamika berbunyi : ” Jika 2 buah benda berada
dalam kondisi kesetimbangan termal dengan benda yang ke 3, maka ketiga benda
tersebut berada dalam kesetimbangan termal satu dengan lainnya” . Untuk lebih memahami tentang isi
hukum ke 0 termodinamika, maka bunyi hukum ini dapat ditulis ulang dengan
kata-kata yang lebih sederhana yaitu Jika benda A mempunyai temperatur
yang sama dengan benda B dan benda B mempunyai temperatur yang sama dengan benda
C maka temperatur benda A akan sama dengan temperatur benda C atau disebut
ketiga benda (benda A, B dan C) berada dalam kondisi kesetimbangan termal.
Kondisi ini dapat digambarkan sebagai berikut:
Gambar 1 kesetimbangan termal antara
benda A, benda B dan benda C
Jika 2 benda yang berbeda temperatur
bersentuhan, maka dikatakan ke dua benda itu berada dalam kondisi kontak
termal. Permukaan tempat kedua benda bersentuhan disebut permukaan kontak
termal. Panas atau dinginnya suatu benda ditentukan oleh banyaknya energi panas
(kalor) yang diserap oleh molekul benda. Besarnya derajat panas benda ini disebut
temperatur benda atau suhu benda.
Temperatur adalah ukuran energi
kinetik yang dimiliki oleh molekul-molekul penyusun suatu benda. Benda-benda di
alam tersusun oleh molekul-molekul dan atom-atom. Molekul yang menyusun benda
tidak berada dalam keadaan diam, tetapi molekul-molekul ini bergetar atau
bergerak secara acak sesuai dengan besarnya energi kinetik yang dimiliki oleh
molekul-molekul. Benda dalam bentuk padat, molekul-molekul penyusunnya tidak
dapat bergerak bebas, tetapi terikat erat dan kaku antara satu dengan lainnya.
Molekul – molekul dalam benda padat hanya dapat bergetar. Ini terjadi karena
energi yang dimiliki oleh molekul dalam benda padat relatif kecil sehingga
tidak dapat melepaskan diri dari ikatan antar molekul.
Bila benda padat ini dipanaskan, maka
sejumlah energi panas (kalor) akan diserap oleh molekul sehingga molekul dapat
bergetar lebih cepat, ini ditunjukan dengan naiknya derajat panas benda. Panas
benda naik karena getaran molekul bertambah besar menyebabkan molekul lebih
banyak bertumbukan dan bergesekan. Semakin banyak kalor dari luar yang diserap
oleh molekul maka molekul akan semakin memiliki energi untuk bergetar dan
bergesekan lebih cepat hingga suatu saat molekul ini tidak lagi saling terikat
tetapi bebas bergerak. Molekul yang bebas bergerak ini masih saling terikat
satu dengan lainnya, inilah yang disebut fase cair benda. Kalor yang diberikan
kepada benda diserap oleh melekul untuk dapat bergetar lebih cepat sehingga
bebas dan dapat bergerak sehingga mengubah fase benda dari benda padat menjadi
benda cair.
Bila kalor terus diberikan, maka gerak
molekul dalam zat cair akan semakin acak, dan tumbukan antar molekul semakin
sering terjadi. Kondisi ini bila berlangsung terus, maka suatu saat molekul
akan benar-benar bebas dan tidak terikat satu dengan lainnya, Kondisi ini
disebut zat cair berubah menjadi gas. Pada fase gas, molekul penyusun gas tidak
saling terikat satu dengan lainnya dan dapat bergerak bebas. Jadi besar
kecilnya temperatur benda ditentukan oleh tingkat energi kinetik yang dimiliki
oleh molekul penyusun benda.
Gambar 2 derajat panas benda
berhubungan dengan perubahan fase benda dan ditentukan oleh besarnya energi
kinetik yang dimiliki oleh molekul-molekul penyusun benda
Kalor dapat berpindah dari satu benda
ke benda yang lainnya. Kalor berpindah dari benda yang memiliki kalor lebih
besar ke benda yang memiliki kalor lebih kecil. Kalor juga didefinisikan
sebagai fluida yang tidak kelihatan. Karena sebagai fluida, maka kalor dapat
mengalir. Hal yang menyebabkan kalor mengalir adalah beda temperatur benda.
Kalor mengalir dari benda atau reservoir yang memiliki temperatur yang
lebih tinggi ke benda atau reservoir yang memiliki temperatur lebih rendah.
Perhatikan gambar berikut ini.
Gambar
3 terdapat 2 benda A dan B yang berbeda temperatur dan terpisah secara termal
Pada gambar 3 terdapat 2 buah benda
yaitu benda A dan benda B yang memiliki temperatur yang berbeda. temperatur
benda A lebih tinggi daripada temperatur benda B. Pada kondisi 1, benda A dan
benda B terpisah secara termal sehingga antara benda A dan benda B tidak
terdapat kontak termal. Pada kondisi 2 benda A ditempelkan ke benda B sehingga
antara benda A dan benda B terdapat kontak termal. Karena temperatur benda A
lebih tinggi dari pada temperatur benda B maka kalor dari benda A akan
berpindah ke benda B. Akibatnya, temperatur benda A akan turun dan temperatur
benda B akan naik. kondisi ini terus berlangsung hingga temperatur benda A sama
dengan temperatur benda B (kondisi 3). Pada saat temperatur benda A sama dengan
temperatur benda B maka kedua benda berada pada kondisi setimbang termal. Pada
saat kedua benda dalam kondisi kesetimbangan termal, tidak ada lagi kalor yang
berpindah dari A ke B atau dari B ke A. (catatan : kondisi lingkungan
diabaikan).
Pertanyaannya
bagaimana dengan 3 buah benda yang berbeda temperatur ?
Misalkan terdapat 3 buah benda yang
memiliki temperatur yang tidak sama, yaitu benda A, benda B dan benda C.
Temperatur benda A lebih besar dari pada temperatur benda B dan benda C,
temperatur benda B lebih besar dari pada temperatur benda C. Perhatikan gambar
berikut ini.
Gambar 4 terdapat 3 buah benda dengan
temperatur yang berbeda yaitu Ta > Tb > Tc
kondisi 1
Gambar 5 benda A kontak termal
dengan benda C, demikian juga benda B kontak termal dengan benda, tetapi benda
A dan B terpisah secara termal
Maka kalor akan berpindah dari benda A
ke benda C dan kalor benda B akan berpindah ke benda C hingga terbentuk
kesetimbangan termal antara ketiga benda.
kondisi 2
Gambar 6 benda B kontak termal dengan
benda C , benda C kontak termal dengan benda B
Pada kondisi ini kalor akan berpindah
dari benda A ke benda B dan kalor benda B akan berpindah ke benda C hingga
terbentuk kesetimbangan termal antara ketiga benda
kondisi 3
Gambar 7 benda A, B dan C berada pada
kondisi kontrak termal
Pada kondisi 3 kalor akan berpindah
dari benda A ke benda B dan ke benda C. Kalor benda B akan berpindah ke benda C
hingga ketiga benda mencapai kesetimbangan termal.
kondisi 4
Gambar 8 benda A dengan benda C kontak
termal, benda A dengan benda B kontak termal
Pada kondisi ini agak unik, karena
kalor dari benda A akan berpindah ke benda B dan benda C. Hal ini terjadi
karena temperatur benda A lebih besar dari benda C dan benda B dan antara benda
A dan C terdapat kontak termal, demikian juga benda A dan B juga terdapat
kontak termal. Benda A dan benda B akan lebih dahulu mencapai kesetimbangan
termal, tetapi kondisi kesetimbangan termal A dan B masih memiliki temperatur
yang lebih tinggi dari benda C. Akibatnya kalor akan berpindah lagi dari benda
A dan B yang sudah setimbang termal ke benda C hingga ketiga benda mencapai
kesetimbangan termal. (catatan : ketiga benda harus memiliki kapasitas panas
yang sama besarnya).
Dalam kehidupan sehari-hari banyak
kita jumpai fenomena yang menggambarkan hukum ke 0 termodinamika. Misalnya pada
saat kita membuat air hangat untuk mandi. Kita mencampur air panas dengan air
dingin. Pada saat air panas dicampur dengan air dingin, maka kalor akan
berpindah dari air panas ke air dingin. Proses perpindahan panas ini
berlangsung beberapa saat hingga tercapai kesetimbangan termal antara air panas
dengan air dingin. Pada saat tercapai kesetimbangan termal antara air panas
dengan air dingin, temperatur air panas akan turun sedangkan temperatur air dingin
akan naik menuju ke temperatur kesetimbangan termal.
Waktu kita mencelup badan ke dalam air
hangat yang sudah mencapai kesetimbangan termal, maka tubuh kita akan merasakan
panas air. Hal ini menunjukan ada sebagian kalor yang berpindah dari air ke tubuh
kita. Hal ini terjadi karena tubuh memiliki temperatur yang lebih rendah
dibandingkan dengan campuran air hangat. Setelah berendam beberapa saat
kita tidak akan merasa panas lagi, karena telah tercapai kesetimbangan termal
antara tubuh dan air.
Waktu kita keluar dari bak mandi
setelah berendam dari air panas, maka tubuh akan terasa dingin. Ini terjadi
karena temperatur ruangan lebih rendah dibandingkan dengan temperatur tubuh
kita akibatnya sejumlah kalor dari tubuh berpindah ke udara di sekitar kita. Pada
saat kalor keluar dari tubuh kita, kita akan merasa lebih dingin.
DAFTAR PUSTAKA
- Khuriati, Ainie. 2007. Termodinamika. Yogyakarta:Graha Ilmu.
- https://djukarna.wordpress.com/tag/hukum-ke-nol-termodinamika/ ( Di Akses Senin, 8 Maret 2015, Jam 19:37 )








Tidak ada komentar:
Posting Komentar